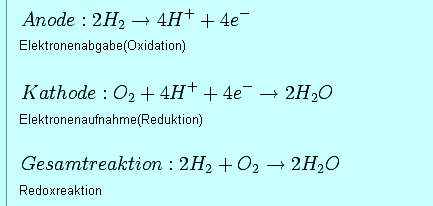Ohne
Energie - keine Zivilisation
Dieser Satz ist eine Binsenweisheit. Die gegenwärtige Zivilisation
ist nur funktionsfähig, wenn täglich 80 Millionen Barrel Rohöl
gefördert und verbraucht werden! Der Energiebedarf
wird heute zu 90 Prozent aus fossilen Brennstoffen gedeckt. Wie total
alle zivilisatorischen Errungenschaften von der Verfügbarkeit (billiger)
Energie abhängig sind, machen folgende Gedankenexperimente deutlich:
Beispiel Öl: Es gibt kein Erdöl mehr: Massenandrang an den Tankstellen, Panikkäufe. Innerhalb weniger Tage würde der gesamte Strassenverkehr zum Erliegen kommen. Alle Ölheizungen bleiben kalt, sobald die Vorräte verbraucht sind.
Beispiel Strom: Ein weltweiter Stromausfall wirft diese Zivilisation innerhalb weniger Wochen zurück ins Mittelalter. Es funktioniert nichts mehr: Kein Licht, keine Waschmaschine, kein Kühlschrank. Die gesamte Kommunikation ist schlagartig unterbrochen: Telefon, Computer, Internet, Fernsehen, Radio - nichts geht mehr. Das wäre vielleicht noch auszuhalten, aber es gibt auch kein Geld mehr - Banken existieren de facto ohne Computer und Internet nicht mehr! Das macht nichts, denn man kann auch kein Geld mehr ausgeben: Nicht nur die Supermärkte bleiben ohne Strom geschlossen, auch die Logistik liegt am Boden und natürlich jede Art von industrieller Produktion. Die Globalisierung ist beendet. Die Natur funktioniert natürlich noch, aber kein 'zivilisierter' Mensch weiss heute noch, wie man mit den natürlichen Recourcen der Natur satt wird und über den Winter kommt.
Vielleicht ist der Peak-Oil heute schon erreicht. Peak-Oil heisst der Zeitpunkt, an dem die Ölförderung weltweit nicht mehr gesteigert werden kann. Fachleute aber sind sich einig, dass dieser Punkt spätestens in zehn Jahren erreicht ist. Viel früher, als man noch zur Jahrtausendwende angenommen hat. Es ist also an der Zeit, sich über alternative Energieträger für die zu Ende gehenden fossilen Brennstoffe Gedanken zu machen.
Ein
idealer Prozess zur Stromerzeugung
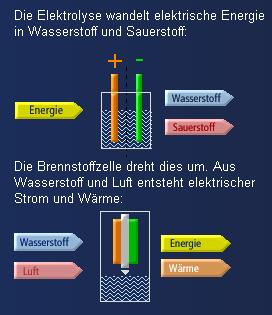
Die Brennstoffzelle funktioniert nach dem Prinzip der Elektrolyse von
Wasser - aber umgekehrt. Die Elektrolyse spaltet unter Stromeinwirkung
Wasser in Wasserstoff und Sauerstoff. Die Brennstoffzelle dagegen verbindet
nach dem umgekehrten Prinzip Wasserstoff und Sauerstoff zu Wasser. Ganz
nebenbei entsteht bei diesem Prozess auch Strom. So sehen die Reaktionsgleichungen
aus:
Die Gesamtreaktion sieht wie der ideale Prozess zur Stromerzeugung aus: Es ist eine 'kalte' Reaktion, theoretisch entsteht kaum Wärme und es muss auch keine Wärme zugeführt werden. Es ist ein kontinuierlicher Prozess, der bei normaler Umgebungstemperatur abläuft. Es werden keine beweglichen Teile benötigt und das Reaktionsprodukt ist Wasser - umweltfreundlicher geht es nicht. 'Brennstoff' für diese Stromerzeugung ist massenweise vorhanden: Wasserstoff und Sauerstoff sind überall verfügbar: Wasser besteht zu zwei Dritteln aus Wasserstoff und 21 Prozent der Luft ist Sauerstoff.
Es scheint so, als ob dieser Prozess ein reales Perpetuum Mobile ist. Aus theoretischer Sicht sind damit alle Energieprobleme der Menschheit gelöst, denn billiger Strom aus unerschöpflichen Recourcen scheint in Aussicht.
Aus theoretischer Sicht. Praktisch gibt es mindestens zwei Probleme: Erstens ist Wasserstoff ein gasförmiges, chemisches Element, das in freier Form in der Natur nicht vorkommt. Zweitens sind schwierigste Probleme zu lösen, um die umgekehrte Elektrolyse von Wasser technisch zu realisieren.
Funktion
der Brennstoffzelle
Wikipedia:
Eine Brennstoffzelle besteht aus zwei Elektroden, die durch eine Membran
oder Elektrolyt voneinander getrennt sind. Die Anode (Minuspol) wird mit
dem Brennstoff umspült (zum Beispiel Wasserstoff, Methan, Methanol,
Glukoselösung), der dort oxidiert wird. Die Kathode (Pluspol) wird
mit dem Oxidationsmittel umspült (zum Beispiel Sauerstoff, Wasserstoffperoxid,
Kaliumthiocyanat), das dort reduziert wird.
Der Brennstoff - beispielsweise Wasserstoff - wird an der Anode katalytisch in Kationen umgewandelt. Das sind beim Beispiel Wasserstoff H+-Ionen. Dies geschieht unter Abgabe von Elektronen an die Anode. Diese Elektronen fließen über einen elektrischen Verbraucher - zum Beispiel eine Glühlampe - zur Kathode. An der Kathode wird das Oxidationsmittel - i.d.R. Sauerstoff - durch Aufnahme der Elektronen zu Anionen. Die negativ geladenen Sauerstoff-Ionen reagieren mit den im Elektrolyt zur Kathode gewanderten H+-Ionen zu Wasser.
Bei hydrogeit.de werden diese Typen von Brennstoffzellen detailliert beschrieben. Ihre Vor- und Nachteile werden verglichen. Eine Gegenüberstellung zwischen der alkalischen Brennstoffzelle und der PEM verdeutlicht die Vor- und Nachteile von Brennstoffzellen mit festem und flüssigem Elektrolyt:
AFC
(Alkaline Fuel Cell)
+ geringe Überspannung der Sauerstoffreduktion
+ hohe spezifische Leitfähigkeit des Elektrolyten
+ preisgünstige Materialien (Kunststoffe) verwendbar
+ einfache Herstellungstechniken ermöglichen Kostensenkung
+ keine Edelmetalle notwendig
- flüssiger, alkalischer Elektrolyt
- Dichtungstechnik BSZ-Block / Elektrolytkreis aufwendiger
- Separator als Elektrolytmatrix erforderlich
- bei Luftbetrieb CO2-Abreicherung oder Adsorption notwendig
PEM
(Proton Exchange Membran)
+ geringe Überspannung der Wasserstoffoxidation an Platin-aktivierten
Anoden
+ Dünnschichtstrukturen ermöglichen hohe Leistungsdichten
+ CO2 inerter Elektrolyt
+ Elektrolytmembran gleichzeitig Gas-Separator+ Festelektrolyt; kein Elektrolytkreislauf
- Membrankosten sehr hoch (Elektrolyt = Proton Exchange Membran)
- Edelmetallkatalysatoren nicht zu substituieren, deswegen teuer
- Herstellungstechnik der Elektroden / Membran-Strukturen aufwendig
- sorgfältige Kontrolle der Wassergleichgewichte / Gradienten in
Membran und Gaskreislauf notwendig
- Sauerstoffreduktion und Kathodenpermeabilität begrenzen Kinetik
Existierende
Brennstoffzellen
Bei
Wikipedia
ist folgende Übersicht über derzeit existierenden Typen von
Brennstoffzellen zu finden:
Bezeichnung |
Elektrolyt |
Anodengas | Kathodengas | Leistung | Betriebstemperatur | Stand |
| AFC Alkaline Fuel Cell |
Kalilauge | Wasserstoff | Sauerstoff | 20 kW | unter 80 °C | Kommerziell
+ Entwicklung |
| PEMFC
Proton Exchange Membrane Fuel Cell |
Polymermembran | Wasserstoff | Sauerstoff | bis
250 kW |
unter 120 °C | Kommerziell + Entwicklung |
| DMFC Direct Methanos Fuel Cell |
Polymermembran | Methanol | Luftsauerstoff | 90 bis 120 °C | Kommerziell + Entwicklung |
|
| PAFC Phosphoric Acid Fuel Cell |
Phosphorsäure | Wasserstoff | Luftsauerstoff | 11 MW | 200 °C | Entwicklung |
| MCFC Molten Carbonate Fuel Cell |
Alkalikarbonat-schmelzen | Wasserstoff, Methan, Kohlegas | Luftsauerstoff | 2,2 MW | 650 °C | Entwicklung |
| SOFC Solid Oxide Fuel Cell |
Oxidkeramischer Elektrolyt |
Wasserstoff, Methan, Kohlegas | Luftsauerstoff | 10 bis 25 KW |
900 bis 1000 °C | Entwicklung |
Herstellung
von Wasserstoff
Es wurden mittlerweile einige Verfahren zur Wasserstoff-Herstellung bis
zur Serienreife entwickelt, andere befinden sich noch im Entwicklungsstadium.
Folgende Verfahren sind einsatzbereit:
- Dampfreformer (Erdgas)
- Partielle Oxidation (Ölvergasung)
- Autotherme Reformer (Methanolreformierung)
- Elektrolyse von Wasser
- Biomasse (Vergasung, Vergärung)
- Kværner-Verfahren
- Wasserstoff aus Grünalgen
Diese Verfahren
werden bei diebrennstoffzelle.de
detailliert beschrieben.
Der Nachteil aller Verfahren: Zur Herstellung von Wasserstoff wird in
jedem Fall Energie benötigt.
Keine
Rettung durch die Brennstoffzelle !
Auch ohne ins Detail zu gehen ist aus dieser Zusammenstellung zu erkennen,
dass die Brennstoffzellen-Technik mit handfesten Problemen zu kämpfen
hat:
- Wie kann Wasserstoff billig erzeugt und dauerhaft gelagert werden?
- Welche Materialien sind als Membran geeignet?
- Welcher Elektrolyt ist geeignet?
- Wie sind hohe Leistung und hoher Wirkungsgrad möglichst bei Raumtemperatur zu erzielen?
- Wie lässt sich die Brennstoffzelle miniaturisieren?
Nur aus diesen
wenigen Fragestellungen ist erkennbar: Die Brennstoffzelle wird unsere
Energiesituation nicht grundsätzlich verbessern. Auch wenn alle technischen
Probleme gelöst wären und zu billigen Brennstoffzellen jeder
Leistungsgrösse führen würden, ein unüberwindliches
Problem ist nicht aus der Welt zu schaffen: Wasserstoff wird als 'Brennstoff'
benötigt und Wasserstoff kommt in der Natur in freier Form nicht
vor. Wasserstoff muss erzeugt und mit aufwendiger Technik (Hochdruck,
Kühlung, Leckverluste) verfügbar gemacht werden. Dieser Aufwand
verringert immer den Gesamtwirkungsgrad der Brennstoffzelle. Der einzige
Vorteil des Verfahrens besteht darin, dass die Recourcen Wasserstoff und
Sauerstoff tatsächlich unerschöpflich sind.
Obwohl die
Reaktionsgleichung ideale Verhältnisse suggeriert,
es werden immer Kosten und hoher technischer Aufwand nötig sein,
um Strom mit Brennstoffzellen zu erzeugen:
Brennstoffzellen
liefern billigen Strom aus unerschöpflichen Recourcen - eine Illusion.
Informationen zu anderen alternativen Energiequellen ...
Weblinks
Im Internet ist alles über die Brennstoffzellen zu finden. Hier nur
einige Links:
- Verzeichnis deutscher Wasserstoffprojekte: http://www.h2guide.de
- Die Brennstoffzelle: http://www.diebrennstoffzelle.de
- Initiative Brennstoffzelle: http://www.initiative-brennstoffzelle.de
- Kassenschlager U-Boot: http://www.forum-brennstoffzelle.de
- Informationsinitiative Brennstoffzelle: http://www.eva.ac.at
- Linksammlung Brennstoffzelle: http://www.eva.ac.at
- Weltgrösste Wasserstofftankstelle eröffnet: http://www.netzeitung.de
- Brennstoffzelle, Grundlagen: http://techni.chemie.uni-leipzig.de
- Brennstoffzelle für Handy: http://www.heise.de
- Brennstoffzelle ist nicht gleich Brennstoffzelle: http://www.heise.de
- Alternative Energieformen: http://www.energieportal24.de